Chagas
La malattia di Chagas, detta anche tripanosomiasi americana, è un’infezione umana cronica provocata parassita protozoo Trypanosoma cruzi (T cruzi) che provoca insufficienza cardiaca e morte nel 20-30% degli individui affetti. Il parassita è tipicamente trasmesso da cimici triatomine conosciute come "Kissing Bugs" negli Stati Uniti, "Barbeiros" in Brasile e con vari altri nomi popolari nei vari paesi endemici del Sud America.
La maggior parte dei circa 8 milioni di persone cronicamente infette vive in centro e sud America, dove la malattia è endemica, ma si stimano circa 300.000 residenti negli Stati Uniti e altri ancora nel resto del mondo. In Sud America, il controllo e la vigilanza hanno avuto successo in alcuni Paesi come Argentina, Cile, Uruguay, Brasile meridionale, San Paolo e Paraguay ma è gravemente in ritardo nei paesi dell’America centrale come El Salvador, Honduras e Guatemala.
CAUSE
Responsabile della malattia di Chagas è il Trypanosoma cruzi, un protozoo parassita che trasmesso da circa 15 generi di Triatomine. Si tratta di insetti della famiglia Reduviidae, che è una delle principali famiglie di cimice, presenti in diverse aree rurali e suburbane dell’America Latina. Vivono prevalentemente nel fango, nella paglia e nelle capanne, dove si nascondono durante il giorno. Sono, invece, attivi di notte, quando escono dai nascondigli per nutrirsi di sangue. È in questo momento che vengono infettate dal parassita, che le raggiunge tramite il sangue di animali già infetti.
T. cruzi ha un ciclo vitale complesso che coinvolge due ospiti, la cimice e praticamente qualsiasi vertebrato e si sviluppa in tre stadi distinti. Lo stadio infettivo è chiamato tripomastigote: il parassita ha un aspetto ondulato, dotato di un singolo flagello, ed è in questa forma che passa dalla cimice all’ospite. A quel punto raggiunge le cellule cardiache e neuronali, dove passa allo stadio di amastigote, più piccolo degli altri due, ovale e senza flagello. Qui si moltiplica, fino a provocare la distruzione della cellula. L’amastigote può quindi tornare alla forma infettiva o diventare epimastigota, simile al primo stadio ma meno ondulato, che ritorna nuovamente alla cimice e si moltiplica nel suo intestino.
TRASMISSIONE
La trasmissione avviene generalmente durante il pasto dell’insetto. Non è però il morso a causare il passaggio del parassita: in questi momenti, oltre a nutrirsi di sangue, la cimice defeca lasciandosi alle spalle il protozoo, che è in grado di entrare nell’ospite attraverso il morso o altre ferite, ma anche penetrando le mucose o la congiuntiva.
L’infezione si può anche verificare in seguito alla trasfusione di sangue infetto, dopo il trapianto di organi, cellule o tessuti di donatori infetti, da madre a figlio durante parto e gravidanza, o per via orale con il consumo di cibi contaminati con le feci della cimice o di carni di animali infetti.
Non abbiamo prove di trasmissione sessuale nell’essere umano, anche se gli studi hanno dimostrato che è possibile in altre specie animali.
DISTRIBUZIONE GEOGRAFICA
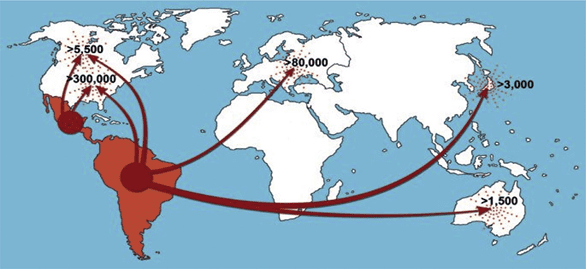
La malattia di Chagas è presente come infezione cronica in circa 8-10 milioni di persone in tutto il mondo, quasi tutti in America Latina (dove la malattia ha avuto origine). Il centroamerica conta da solo l’11% dei casi di tutto il continente, ma in seguito ai flussi migratori verso il resto del mondo si stimano oltre 300.000 casi in Nord America, 80.000 in Europa, 3.000 in Asia Orientale e 1.500 in Australia.
Hanno avuto effetti estremamente positivi gli sforzi di controllo nell’estremità meridionale delle Americhe, dove in Argentina, Cile, Brasile, Paraguay e Uruguay si registra un importante calo del numero di casi.
L’immagine di seguito raffigura l’incidenza globale di portatori infettati da T cruzi.
(Da Coura-Rodrigues J, Albajar-Vinas P. Chagas disease: a new worldwide challenge. Nature 2010; 465: S7;).
SINTOMI
Poiché l’infezione clinica da T. cruzi causa sintomi minimi è difficile da diagnosticare e non viene quasi mai curata, in particolare nei Paesi in via di sviluppo.
Il periodo di incubazione dura tipicamente circa una settimana. Trascorso questo periodo, la malattia si sviluppa in due fasi, acuta e cronica.
Nello stadio acuto, che dura settimane o mesi (mediamente la durata si assesta attorno ai due mesi), la maggior parte delle persone non presenta sintomi, oppure sintomi estremamente lievi e che tendono a risolversi da soli (però possono essere letali nei bambini e negli individui immunocompromessi) come:
- Febbre;
- mal di testa;
- ingrossamento dei linfonodi;
- pallore;
- dolori muscolari;
- difficoltà di respirazione;
- dolori addominali e toracici.
In questa fase è presente un’elevata presenza di parassiti nel sangue, che come tripomastigoti vanno a invadere il fegato, l'intestino, la milza, i gangli linfatici, il sistema nervoso centrale e i muscoli scheletrici e cardiaci, dove assumono la forma di amastigoti e provocano una reazione infiammatoria locale.
Poiché molti dei sintomi sono generalmente difficili da identificare, la malattia spesso non viene diagnosticata. Il parassita entra quindi in una fase cronica, in cui la sua presenza nel sangue è molto bassa e diventa sostanzialmente non rilevabile.
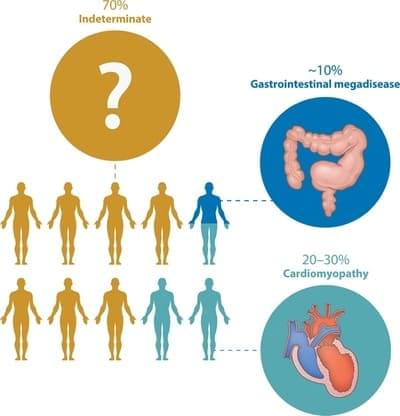
Nella maggior parte dei casi la malattia non riemerge più (forma indeterminata), ma è possibile che dopo un periodo di tempo che va dai 10 ai 20 anni dopo l’infezione acuta, tornino a presentarsi sintomi di questa nuova fase. Il 30% delle persone sviluppa problematiche cardiache, che possono sfociare anche in aritmie fatali. Nel 10% dei casi si hanno invece problematiche collegate all’apparato digerente, in particolare esofago e colon.
DIAGNOSI
La diagnosi della malattia di Chagas è problematica poiché lo screening non è né obbligatorio come parte del processo di immigrazione né raccomandato dall'American Academy of Pediatrics.
Molteplici barriere diagnostiche, culturali ed economiche limitano la diagnosi e il trattamento della malattia di Chagas.In particolare, un progetto di screening della malattia di Chagas dell'Università del Texas incentrato sulla Valle del Rio Grande, ha riscontrato problemi tecnici significativi per la mancanza di specificità dei test diagnostici disponibili.
Nei Paesi industrializzati vengono utilizzate metodiche di diagnosi quali:
- Microscopia ottica di strisci di sangue (goccia spessa o striscio sottile) o di tessuto (malattia acuta di Chagas);
- Test sierologico di screening confermato da un secondo test;
- Test basati sulla reazione a catena della polimerasi
TRATTAMENTO
Trattamento di neonati e bambini infetti
I casi di infezione congenita da T. cruzi devono essere trattati non appena la diagnosi è stata confermata. L'attuale esperienza di gruppi clinici esperti nel trattamento dell'infezione congenita da T. cruzi conferma che sia il benznidazolo (BZ) che il nifurtimox (NF) possono essere usati per trattare casi congeniti.
Il trattamento è altamente efficace con eventi avversi inferiori a quelli descritti negli adulti. Le percentuali di guarigione, valutate dalla sierologia convenzionale, sono superiori al 90% nei neonati trattati durante il primo anno di età.
Il follow-up del trattamento è raccomandato mediante test parassitologici o molecolari nelle settimane successive all'inizio del trattamento per i neonati che manifestano la presenza del parassita. Dopo il completamento del trattamento, i pazienti devono essere seguiti ogni 6 mesi con test sierologici quantitativi: il paziente è considerato guarito quando il test diventa negativo.
Trattamento di ragazze o adulti infetti
Anche nella popolazione più adulta, i pazienti affetti da T. cruzi dovrebbero essere trattati con benznidazolo (BZ) o il nifurtimox (NF) secondo le raccomandazioni standard dell'OMS.
Tuttavia, il trattamento antiparassitario è controindicato durante la gravidanza, poiché i rischi dell'uso dei medicinali disponibili BZ e NF sul feto sono sconosciuti e il rischio di reazioni avverse è maggiore negli adulti. Le madri infette saranno quindi trattate dopo il parto e il periodo di allattamento per evitare l'interruzione dell'allattamento a seguito di tali possibili reazioni avverse.
PREVENZIONE
Non sono disponibili vaccini che proteggano dalla malattia di Chagas, pertanto bisogna adottare dei comportamenti volti a prevenire la puntura dell’insetto. L’uso di insetticidi aiuta, così come non dormire su giacigli di paglia o fango, staccare il letto dalle pareti e controllare l'assenza di insetti dietro ai mobili, utilizzare repellenti e zanzariere da letto (meglio se impregnate di insetticida).
Bibliografia
Justin R. Harrison, Sandipan Sarkar, Shahienaz Hampton, Jennifer Riley, Laste Stojanovski, Christer Sahlberg, Pia Appelqvist, Jessey Erath, Vinodhini Mathan, Ana Rodriguez, Marcel Kaiser, Dolores Gonzalez Pacanowska, Kevin D. Read, Nils Gunnar Johansson, and Ian H. Gilbert. Discovery and Optimization of a Compound Series Active against Trypanosoma cruzi, the Causative Agent of Chagas Disease. Journal of Medicinal Chemistry, ACS Publications, American Chemical Society.
Luis E. Echeverria, MDa, Carlos A. Morillo, MD, FRCPC, FESC, FHRSb,* American Trypanosomiasis (Chagas Disease). Infect Dis Clin N Am 33 (2019) 119–134. 0891-5520/19/a 2018 Elsevier Inc.
Kevin M. Bonney1, Daniel J. Luthringer2, Stacey A. Kim2, Nisha J. Garg3, David M. Engman. Pathology and Pathogenesis of Chagas Heart Disease. Annu Rev Pathol. 2019 January 24; 14: 421–447.
Clever Gomesa, Adriana B. Almeidab, Ana C. Rosab, Perla F. Araujob, Antonio R.L. Teixeira
American trypanosomiasis and Chagas disease: Sexual transmission. 1201-9712/© 2019 Published by Elsevier Ltd on behalf of International Society for Infectious Diseases.
Roger M. Mills MD , Chagas Disease. Epidemiology and Barriers to Treat- ment, The American Journal of Medicine (2020)





