Febbre emorragica Crimea-Congo
La febbre emorragica di Crimea-Congo (CCHF) è una forma grave di febbre emorragica causata da un virus del genere Nairovirus. I primi casi sono stati documentati nel 1944 quando le forze armate sovietiche si scontrarono con l'esercito tedesco in Crimea, ma abbiamo descrizioni del XII secolo di una malattia probabile assimilabile in Tagikistan.
Il virus è stato identificato solo nel 1967, quando il medico sovietico Mikhail Chumakov (responsabile, tra le altre cose, della scoperta del virus dell’encefalite da zecche) lo isolò in un paziente uzbeko. Parallelamente, nel 1956 era stato isolato nella Repubblica Democratica del Congo un virus responsabile di una malattia molto simile. Nel 1969 è arrivata la conferma della vicinanza tra i due virus, dando così il nome odierno alla malattia.
CAUSE
Il virus CCHF appartiene al genere Nairovirus, dell'ordine Bunyaviridae. Il genere Nairovirus comprende 34 diversi virus suddivisi in 7 distinti sottogruppi sierologici, di cui 3 possono causare malattie nell'uomo.
Il genoma del nairovirus è strutturato in 3 segmenti di RNA a filamento singolo, denominati L, M e S in base alle rispettive dimensioni. Il virione è costituito da un involucro lipidico e il suo diametro misura circa 90 – 120 nm.
Oggi l'RNA virale (in particolare il segmento S) è stato sequenziato e sono state identificate otto linee genetiche.
- Un ceppo europeo che comprende i virus trovati nell'Europa orientale che coprono una regione compresa fra la penisola balcanica e la Russia, passando attraverso la Turchia.
- Il ceppo AP92 identificato principalmente in Grecia, forma un gruppo indipendente ed è probabilmente meno patogeno.
- Il ceppo presente in Asia centrale (Kazakistan, Tagikistan, Uzbekistan e Cina)
- Il ceppo Pakistan/Madagascar più alcuni individuati in Iran.
- Il ceppo costituito dai ceppi rimanenti trovati in Iran, a cui si aggiungono quelli de Senegal e della Mauritania.
- Gli altri tre lignaggi si trovano solo in Africa.
Il virus CCHF è stato trovato in una trentina di specie diverse di zecche. Il vettore più efficiente appartiene al genere Ixodes, la zecca Hyalomma marginatum, che può acquisire il virus nutrendosi di un ospite infetto.
Il virus si replica nell’organismo della zecca, in particolare nelle cellule della parete intestinale, e si diffonde a vari tipi di tessuto, raggiungendo le concentrazioni più elevate nelle ghiandole salivari e negli organi riproduttivi.
I vertebrati sono gli ospiti che più contribuiscono alla diffusione della CCHF. Le indagini sul tasso di sieropositività hanno dimostrato che i grandi erbivori sono più frequentemente infetti. Gli uccelli invece non sviluppano il virus, ad eccezione degli struzzi, seppure contribuiscano a diffondere la malattia trasportando zecche infette da CCHF per centinaia di chilometri.
TRASMISSIONE
L'infezione umana di solito si verifica tramite contatto con il sangue infetto di una zecca (per puntura diretta o schiacciando una zecca infetta con le mani senza guanti).
Un aumento del numero di casi si registra in primavera e in estate, quando le zecche adulte si nutrono per completare il loro ciclo vitale, specialmente se l'inverno precedente è stato mite, favorendo la sopravvivenza di questi aracnidi.
La capacità delle zecche di trasmettere il virus CCHF all'uomo dipende anche dall'ecosistema in cui si sviluppano. Nelle regioni in cui è presente un gran numero sia di piccoli mammiferi come lepri e ricci che di grandi mammiferi come bovini e ovini, il virus sembra circolare silenziosamente con solo pochi sporadici casi umani "accidentali".
Al contrario, come sembrava essere avvenuto in Crimea nel 1944, quando le lepri selvatiche avevano proliferato nelle fattorie abbandonate durante l'occupazione tedesca e il numero di animali da allevamento era diminuito significativamente, i soldati e i braccianti che ripopolavano l'area rappresentavano indirettamente una nuova fonte di sangue per le zecche Hyalomma adulte, con conseguente elevata incidenza di casi di CCHF nell'uomo.
Gli esseri umani possono anche essere infettati dal contatto diretto con sangue animale o altri tessuti infetti, sebbene l'acidificazione muscolare dopo la morte dell'animale inattivi il virus.
In uno studio che descrive una serie di 1.820 casi registrati in Turchia tra il 2002 e il 2007, il 62% dei pazienti ha riferito di aver avuto uno stretto contatto con animali. Quasi il 90% dei casi segnalati si è verificato in allevatori, lavoratori dei macelli o macellai. È stato inoltre dimostrato che il tasso di sieropositività è più elevato nelle categorie appena menzionate, oltre che nei pazienti anziani e in quelli di stato socioeconomico inferiore.
I casi umani si osservano prevalentemente negli individui di genere maschile, fatto fortemente correlato alla distribuzione delle mansioni nei paesi a rischio, dove le attività agricole sono per lo più svolte da uomini.
Dovrebbe essere considerata anche la possibile trasmissione sessuale di CCHF, sebbene siano stati documentati pochissimi casi. Sono stati segnalati invece diversi casi di trasmissione da madre a figlio, con gravi sindromi emorragiche nei neonati e successiva morte. In queste circostanze però non tutti i neonati sono infetti, il che suggerisce che il virus non si trasmetta verticalmente in tutti i casi.
DISTRIBUZIONE GEOGRAFICA
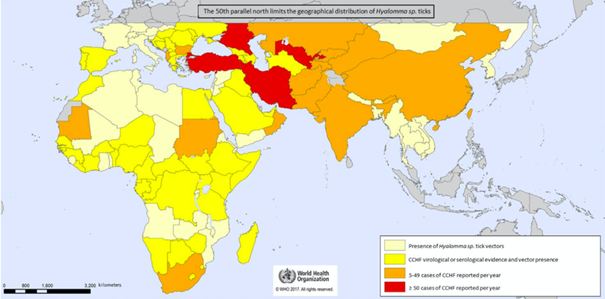
Il CCHF ha la distribuzione geografica più ampia di tutti i virus trasmessi dalle zecche con conseguenze sull'uomo e la seconda distribuzione geografica più estesa di tutti gli arbovirus dopo il virus Dengue.
Durante il XX secolo i principali focolai di CCHF si sono verificati nell'ex Unione Sovietica (ad esempio Crimea, Rostov, Astrakhan), in Bulgaria con 1.105 casi segnalati tra il 1953 e il 1974 e in Cina dove 260 agricoltori sono stati infettati tra il 1965 e il 1994 nella regione dello Xinjiang, con una mortalità riportata dell'80% (probabilmente distorta perché sono stati registrati solo i casi più gravi).
Attualmente i principali focolai si trovano in Medio Oriente (Turchia e Iran), con oltre 10.000 casi documentati in Turchia dal 2002.
Sono stati effettuati numerosi studi per determinare il tasso di sieropositività e delimitare l'area geografica colpita dal virus. Un numero elevato di casi di sieropositività si è riscontrato nei ruminanti (pecore, mucche, capre), ospiti amplificatori di CCHF che fungono da indicatori affidabili della presenza del virus in alcune regioni.
Esiste una relazione logica tra un alto tasso di sieropositività negli animali in una data regione e l'incidenza della malattia nell'uomo. Infatti, in uno studio condotto su 1.165 ruminanti in Bulgaria e Turchia, sono stati riportati tassi di sieropositività rispettivamente del 26% e del 57%, con importanti divergenze da regione a regione.
In Africa, sebbene rispetto al Medio Oriente siano riportati meno casi umani di CCHF, i tassi di sieropositività sono talvolta elevati nel bestiame con l'1,6% nella Repubblica Democratica del Congo, il 66% in Mali, il 67% in Mauritania e il 21% nei dromedari in Sudan.
In Europa l’infezione si attesta a livello inferiore rispetto alle regioni africane su menzionate, è stata tuttavia identificata nel bestiame presente in Bulgaria, Ungheria, Albania, Kosovo e Grecia, e persino in due pipistrelli nel sud della Francia.
Nel 2002 il virus è stato inoltre rilevato per la prima volta nelle zecche prelevate dai cervi in Spagna. Il ceppo di appartenenza era quello africano, filogeneticamente correlato al ceppo ritrovato nelle zecche infestanti gli uccelli migratori del Marocco. Ad oggi però sono pochissime le zecche che in Spagna sono state trovate portatrici del virus, tra lo 0 e il 3,2%.
SINTOMI
I tassi di sieropositività molto elevati riscontrati in alcune aree endemiche (fino al 27% in alcune regioni della Romania e della Grecia), suggeriscono che moltissimi casi di CCHF sono asintomatici o causano sintomi così limitati che i pazienti non cercano cure mediche. Si stima che l'88% dei pazienti sieropositivi in Turchia, infatti, abbia manifestato solo sintomi limitati.
Nei casi sintomatici, il tempo medio di incubazione è compreso tra i 2 e i 7 giorni. L'esordio è improvviso, con febbre, dolori muscolari, vertigini, dolore e rigidità al collo, mal di schiena, mal di testa, bruciore agli occhi e fotofobia (sensibilità alla luce). Si possono verificare inoltre nausea, vomito, diarrea, dolori addominali e mal di gola nella fase iniziale, seguiti da sbalzi d'umore e confusione.
Dopo circa 4 o 5 giorni inizia la fase emorragica, caratterizzata da sanguinamento delle mucose: epistassi, ematemesi, più raramente melena (presenza di sangue nelle feci), emottisi (espulsione di sangue con i colpi di tosse) ed ematuria (presenza di sangue nelle urine), ma il sanguinamento si osserva spesso anche nella pelle (ecchimosi/porpora).
La fase di convalescenza inizia 10-20 giorni dopo l'insorgenza dei primi sintomi clinici e dura una decina di giorni. I pazienti manifestano affaticamento marcato, tachicardia con pressione sanguigna labile, alopecia temporanea e disturbi della memoria.
DIAGNOSI
La diagnosi precoce è difficile data l’aspecificità della sintomatologia, poiché anche le manifestazioni emorragiche sono caratteristiche di altre malattie infettive delle stesse aree geografiche.
Alcuni fattori determinanti devono essere inevitabilmente presi in considerazione come:
- Il morso di zecca;
- il contatto con bestiame;
- l’appartenenza a particolari categorie professionali in area endemica;
- contatto interumano, anche per ragioni professionali con casi di CCHF, in particolare in corso di epidemie accertate o sospette.
La diagnosi virologica di CCHF si avvale della sierologia e della rilevazione del virus. Gli anticorpi (rilevati con metodiche ELISA, immunofluorescenza e neutralizzazione) compaiono 5-7 giorni dopo l’esordio della malattia e nella prima fase le tecniche molecolari risultano più utili nella diagnosi. Tuttavia, le IgG specifiche vengono rilevate per almeno 5 anni.
Un'infezione in fase acuta può quindi essere documentata rilevando le IgM (ma non le IgG) in un campione di siero iniziale, quindi IgM e IgG contemporaneamente, o la sieroconversione con un aumento di quattro volte del titolo anticorpale tra due campioni successivi di siero. La specificità dei test sierologici è eccellente, senza che siano stati segnalati falsi positivi o reattività crociata con altri virus.
TRATTAMENTO
Non esiste una terapia farmacologica specifica per la CCHF. La cura dei pazienti con CCHF si basa sul trattamento sintomatico, andando a gestire lo squilibrio elettrolitico causati da disturbi gastrointestinali, correggendo l'emostasi in caso di sanguinamento ( con plasma fresco congelato o trasfusione di piastrine), trasfusione di cellule concentrate.
Sulla base di incoraggianti dati, alcuni autori raccomandano il trattamento con la ribavirina che sembra essere in grado di ridurre il tasso di mortalità, ma solo se somministrata in una fase iniziale della malattia. Anche il trattamento profilattico post-esposizione sembra ridurre il rischio di infezione.
PREVENZIONE
È importante che le persone che si recano in aree endemiche siano adeguatamente informate sulle misure di controllo dei vettori contro le malattie trasmesse dalle zecche (repellenti, indossare abiti lunghi), la necessità di indossare guanti per rimuovere le zecche, i rischi di contaminazione tramite il contatto con il bestiame o nei processi di lavorazione della carne. Il rischio di contrarre la malattia durante un viaggio in un'area endemica, e quindi di reimportazione nei propri paesi di origine, è in ogni caso considerato molto basso.
Per quanto riguarda un vaccino, gli studi sugli animali hanno condotto a risultati divergenti. Un team è riuscito a innescare nei topi una risposta immunitaria sia cellulo-mediata che umorale utilizzando un ceppo vaccinale, reazione che non ha tuttavia ridotto il tasso di mortalità.
Attualmente sono in corso sperimentazioni sui vaccini di fase 1 nell'uomo, ma gli anticorpi prodotti sembrano avere solo una limitata capacità di neutralizzazione del virus.
Bibliografia:
- Bente DA, Forrester NL, Watts DM, McAuley AJ, Whitehouse CA, Bray M. Crimean-Congo hemorrhagic fever: history, epidemiology, pathogenesis, clinical syndrome and genetic diversity. Antiviral Res 2013;100(1):159–89.
- Papa A, Weber F, Hewson R, Weidmann M, Koksal I, Korukluoglu G, et al. Meet- ing report: First International Conference on Crimean-Congo hemorrhagic fever. Antiviral Res 2015;120:57–65.
- Spengler JR, Bente DA, Bray M, Burt F, Hewson R, Korukluoglu G, et al. Second International Conference on Crimean-Congo Hemorrhagic Fever. Antiviral Res 2018;150:137–47.
P. Fillâtre, M. Revest, P. Tattevin. Crimean-Congo hemorrhagic fever: An update. Fièvre hémorragique de Crimée-Congo: mise au point. 0399-077X 2019 Elsevier.





